-
Clasificación de los fármacos simpaticomiméticos
utilizados en el tratamiento del asma, de acuerdo al tipo de receptor estimulado.
|
-
Con efecto a y b ( a 1, a 2,
b 1 y b 2)
|
 Adrenalina
Adrenalina |
 Efedrina
Efedrina |
-
Con efecto b no selectivo (b 1- b 2)
|
 Isoproterenol
Isoproterenol |
|
|
 Isoetarina
Isoetarina |
 Metaproterenol (b 1 en menor grado)
Metaproterenol (b 1 en menor grado) |
 Terbutalina
Terbutalina |
 Albuterol (Salbutamol)
Albuterol (Salbutamol) |
 Pirbuterol
Pirbuterol |
 Bitolterol
Bitolterol |
 Fenoterol
Fenoterol |
 Ritodrina
Ritodrina |
 Formoterol
Formoterol |
 Salmeterol
Salmeterol |
 Clenbuterol
Clenbuterol |
 Tulobuterol
Tulobuterol |
| Como se puede apreciar en esta clasificación
hay una gran cantidad de fármacos simpaticomiméticos que
además de estimular los receptores b 2 también
estimulan los receptores a y b 1, lo cual es inconveniente ya
que dan origen a una serie de efectos colaterales derivados de esta estimulación.
En concordancia, se han desarrollado drogas con afinidad preferencial por
los receptores b 2 en comparación con los b 1.
Sin embargo, la selectividad no es absoluta y se pierde en concentraciones
suficientemente elevadas de estas drogas. |
| C. Relación estructura química-actividad |
| La b -fenil etilamina se puede considerar
el compuesto precursor a partir del cual derivan los medicamentos simpaticomiméticos.
Está constituida por un anillo bencénico o fenilo con una
cadena lateral que es etilamina. |
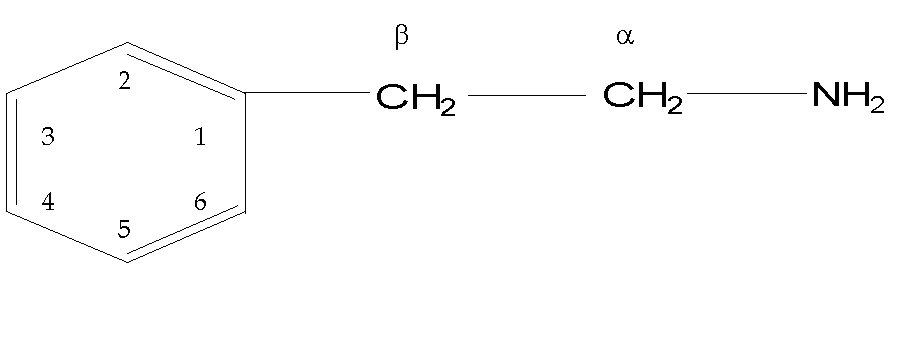 |
| Las sustituciones en la molécula
de la b -fenil etilamina van a dar lugar a modificaciones en los efectos
de los medicamentos. Estas sustituciones pueden hacerse: |
-
En el grupo amino-terminal.
|
|
En el anillo bencénico.
|
|
En los carbonos a o b .
|
-
La sustitución por grupos ľOH en las posiciones
3 y 4 origina a los fármacos simpaticomiméticos conocidos
como CATECOLAMINAS.
|
|
El incremento en el tamaño de los sustitutos
en el radical amino tiende a incrementar la actividad del receptor b :
cuanto más grande sea el sustituto en el grupo amino menor será
la actividad sobre los receptores a .
|
|
La sustitución de un metilo en la NORADRENALINA
produce ADRENALINA y amplifica la actividad de los receptores b 2.
|
|
La sustitución de un isopropilo en la NORADRENALINA
produce ISOPROTERENOL, el cual tiene, mayor actividad beta y casi nula
alfa.
|
|
Los agonistas b 2 selectivos requieren
por lo general un sustituto en el grupo amino de gran tamaño.
|
|
La ausencia de uno o ambos grupos ľOH en el anillo
fenilo da lugar a agentes simpaticomiméticos pero no catecolamínicos,
es decir una molécula no susceptible a la inactivación por
la COMT (enzima catecol o-metiltransferasa que se encuentra principalmente
en intestino e hígado).
|
|
Estos agentes tienen una mayor biodisponibilidad
después de la administración oral y una mayor duración
de acción en comparación con las catecolaminas. Además,
cuando están los 2-OH ausentes aumenta la distribución de
la molécula en el sistema nervioso central.
|
|
La sustitución en el carbono a impide la oxidación
de la molécula por la enzima monoaminooxidasa (MAO) prolongando
la acción de tales agentes y le confiere capacidad para desplazar
a las catecolaminas de sus sitios de almacenamiento en los nervios adrenérgicos,
por ejemplo, la efedrina que tiene acción mixta.
|
-
Mecanismo de Acción
|
| El mecanismo de acción de los
agonistas beta ha sido estudiado con gran detalle. La activación
de los tres subtipos de receptores (beta 1, beta2
y beta 3) promueve la activación de la proteina Gs (estimulante
del acoplamiento) la cual va a estimular la activación de la enzima
adenilciclasa, lo que conduce a la disociación de la subunidad a
cargado con GTP. Esta subunidad a s activa de manera directa
la adenilciclasa, dando como resultado un aumento en la velocidad de síntesis
del AMPc a partir del ATP. El AMPc es el principal segundo mensajero en
la activación de receptores beta. |
| Este incremento en el AMPc acelera
la inactivación de las cinasas tipo A de las cadenas ligeras de
miosina (MLCK) y facilita la expulsión de calcio de la célula
y/o su secuestro en el retículo sarcoplásmico lo que conlleva
a la relajación en el músculo liso. |
|
Acciones Farmacológicas.
|
| La acción mejor caracterizada
de los agonistas de los adrenoreceptores de las vías respiratorias
es la relajación del músculo liso de las mismas con la broncodilatación
resultante. En general, la estimulación de los receptores b 2,
relaja la musculatura lisa de las vías respiratorias, inhibe la
liberación de mediadores broncoconstrictores a partir de las células
cebadas y también puede aumentar el transporte mucociliar, incrementando
la actividad de los cilios o modificando la composición de las secreciones
mucosas. |
|
Utilidad de estos agentes en el tratamiento del
Asma
|
| Los estudios con provocación
demuestran que los agonistas b -adrenérgicos pueden anular la respuesta
asmática inmediata (broncoespasmo) pero carecen de efectos sobre
la respuesta asmática tardía. |
| Los agonistas adrenérgicos
en aerosol son potentes broncodilatadores que se pueden usar solos para
el tratamiento del Asma leve o intermitente o para prevenir o revertir
el asma inducida por el ejercicio. |
| En conclusión, los agentes
simpáticomiméticos selectivos son útiles en el tratamiento
del Asma intermitente, del Asma Alérgica Estacionaria y Perenne
y del Asma Inducida por el Ejercicio. Además, son los medicamentos
auxiliares para emplear en combinación con el Cromoglicato o los
corticosteroides inhalatorios en el manejo del Asma Crónica. |
| En el tratamiento inmediato (por inhalación)
del broncoespasmo, al parecer hay pocas bases para elegir entre los agentes
selectivos como el albuterol, terbutalina., etc. ya que cada uno de estos
agentes tiene un comienzo de acción relativamente breve e igual
eficacia. |
| |
| F. Agentes Específicos |
-
ADRENALINA
|
| Fue utilizada por primera vez como
broncodilatador a principios de este siglo. |
| Es un potente estimulante de los receptores
tanto alfa como beta adrenérgicos, por lo cual son complejos sus
efectos en los órganos blancos. |
| Produce una broncodilatación
eficaz, de acción rápida cuando se inyecta por vía
subcutánea o inhalada como un microaerosol a partir de un dispositivo
presurizado. La broncodilatación máxima se logra en 15 minutos
después de la inhalación y dura 60 a 90 minutos. |
| La adrenalina es sustrato de la momoaminooxidasa
(MAO) y de la catecol o-metiltransferasa (COMT) por lo que su efecto es
rápido. |
| Debido a que la adrenalina estimula
receptores a y b (tanto b 1 como b 2) presenta efectos
adversos problemáticos como taquicardia, arritmias, hipertensión
arterial, agravamiento de la angina de pecho, ansiedad y tremor. |
|
EFEDRINA
|
| Es quizá el fármaco
que tiene la historia más larga que cualquier otro agente, en el
tratamiento del asma ya que se utilizó en China por más de
2.000 antes que se introdujera en la medicina occidental en 1924. |
| Comparada con la adrenalina, la efedrina
es menos potente, pero su acción es más prolongada (2-4 horas). |
| Tiene actividad por vía oral
y sus efectos centrales son más pronunciados. |
| Debido a que estimula tanto receptores
alfa como beta adrenérgicos, sus efectos adversos son similares
a los producidos por la adrenalina. |
| No tiene ventajas sobre agentes más
selectivos, excepto por su bajo costo y su uso debe evitarse si es posible. |
|
ISOPROTERENOL
|
| Fue introducido en la década
de los 40 como un beta agonista puro y fue muy utilizado como broncodilatador. |
| El isoproterenol relaja casi todas
las variedades de músculo liso cuando su tono es alto, pero esta
acción es más pronunciada en los músculos lisos bronquial
y gastrointestinal. |
| Además, al estimular los receptores
beta 1, produce un efecto cronotrópico e inotrópico
positivo con aumento del volúmen minuto, pero puede producir palpitaciones,
taquicardia y arrítmias y debido a la relajación del músculo
liso vascular disminuye la resistencia vascular periférica con disminución
de la presión arterial diastólica. Otros efectos adversos
son hiperglicemia y tremor. |
| El isoproterenol se absorbe con facilidad
cuando se administra en forma de aerosol. Se metaboliza en el hígado
y otros tejidos por acción de la COMT. Es un sustrato relativamente
malo para la MAO, por lo que la duración de acción es un
poco más prolongada que la de la adrenalina (1-2 horas), pero aún
así, sigue siendo breve. |
| Hoy en día estos fármacos,
casi no se usan en el tratamiento del asma por el advenimiento de los agonistas
de adrenoreceptores beta2 selectivos, los cuales son eficaces
por vía oral, de mayor duración de acción y con selectividad
beta2 lo que determina menor probabilidad de efectos adversos. |
| |
| FARMACOS BETA 2 SELECTIVOS |
| Estos fármacos son los simpaticomiméticos
más usados para el tratamiento del asma en la actualidad. |
| En general, poseen una mayor selectividad
por el receptor beta 2 adrenérgico, mejor cinética,
mayor duración de acción y menores efectos secundarios. |
-
ISOETARINA
|
| Fue el primero de los agentes con
selectividad por los beta 2 receptores. Como el isoproterenol,
es una catecolamina de acción corta. Se emplea en forma de aerosol,
pero su acción breve la hace menos popular que otros agentes selectivos |
|
METAPROTERENOL
|
| Es un análogo del isoproterenol,
con una acción moderadamente prolongada. La presencia de grupos
hidroxilo en la posición meta del ciclo bencénico, otorga
resistencia a la degradación por la COMT y proporciona una mayor
selectividad para los receptores beta 2, aunque tal vez, lo
sea menos que el albuterol o la terbutalina. |
| Puede ser administrado por vía
oral o por inhalación. |
| Por inhalación, sus efectos
se producen en un plazo de minutos y persisten durante varias horas. |
| Por vía oral, su acción
se inicia con mayor lentitud pero sus efectos duran de tres a cuatro horas. |
| Sus efectos adversos principales son,
temblor del músculo esquelético, nerviosismo y debilidad
ocasional. |
|
TERBUTALINA
|
| Posee una selectividad para los receptores
beta 2 levemente mayor, que los dos fármacos anteriores. |
| No es un buen sustrato para la metilación
de la COMT, por lo que es eficaz por vía oral, también puede
administrarse por vía subcutánea o por vía inhalatoria. |
| Por vía oral, el efecto se
inicia en 1-2 horas y dura aproximadamente 8 horas. Por vía subcutánea,
el efecto se inicia aproximadamente en 20 minutos y dura 6 horas y por
vía inhalatoria el efecto se inicia en pocos minutos, persistiendo
por 6 horas aproximadamente. |
| Sus efectos adversos son similares
a los producidos por el metaproterenol. |
|
ALBUTEROL (SALBUTAMOL)
|
| También es un agente beta2
adrenérgico, relativamente selectivo. |
| Se dá por inhalación
o por vía oral. |
| Inhalado, produce broncodilatación
importante en plazo de 15 minutos y sus efectos son demostrables hasta
por 3 o 4 horas. |
| Por vía oral, su acción
puede persistir hasta por 8 horas |
| En dosis de igual efecto broncodilatador,
el albuterol causa menos efectos cardíacos que el isoproterenol. |
|
PIRBUTEROL
|
| Es un agonista beta2 selectivo
que, desde el punto de vista estructural es muy parecido al albuterol. |
| Se administra solo por vía
inhalatoria. |
| |
| 6.BITOLTEROL |
| Este agonista b 2 adrenérgico
es un profármaco, el cual es hidrolizado por los esterasas del pulmón
y de otros tejidos a su forma activa: colterol. También se administra
por vía inhalatoria. |
| Tiene un comienzo de acción
relativamente breve y puede generar un período más largo
de broncodilatación útil, en comparación con los demás,
tal vez porque debe transformarse en colterol en los pulmones antes de
proseguir su metabolismo. |
| Sin embargo su sabor desagradable
ha desalentado su utilización. |
|
FENOTEROL
|
| Por inhalación inicia su actividad
pronto y su efecto broncodilatador dura aproximadamente 2-3 horas. |
| También se ha utilizado ampliamente
para demorar o evitar el parto prematuro. |
|
RITODRINA
|
| Es un agonista beta 2 selectivo,
que se desarrolló de manera específica para emplearse como
relajante uterino. No obstante, sus propiedades farmacológicas son
muy similares a las de otros fármacos este grupo. |
| La ritodrina se administra por vía
intravenosa a pacientes seleccionadas para detener el trabajo de parto
prematuro. Si dá buenos resultados, se instituye a continuación
tratamiento por vía oral con este compuesto. |
| Entre los agonistas b 2
selectivos más recientes se incluyen: |
| FORMOTEROL y SALMETEROL |
| Ambos fármacos son altamente
selectivos y potentes. |
| Tienen un mayor tiempo de acción
(12 horas o más) respecto a los fármacos anteriores, lo que
posiblemente se debe una alta solubilidad en lípidos más
que a resistencia al metabolismo. |
| El formoterol produce broncodilatación
importante a los pocos minutos de inhalado, mientras que el salmeterol
inicia sus efectos con lentitud relativa tras la inhalación, de
modo que no es adecuado por si solo para el pronto alivio de las crisis
agudas de broncoespasmo. Produce una broncodilatación de al menos
12 horas luego de la inhalación de una dosis farmacológica
terapéutica. Esta larga duración del efecto, lo hace particularmente
útil o apropiado en pacientes con asma nocturna en los cuales logra
mejorar la calidad del sueño. |
| CLENBUTEROL Y TULOBUTEROL |
| También producen una mayor
duración del efecto broncodilatador (12 horas), lo que permite su
administración BID y un mejor control del asma nocturna. |
| |
| H. Vías de administración
de los agonistas b 2 adrenérgicos |
| ¨ Vía inhalatoria |
| En el tratamiento del asma, la mejor
vía de administración para los fármacos agonistas
beta 2 selectivos, es la vía inhalatoria y los dos tipos
de dispositivos utilizados en la terapéutica con aerosol son los
inhaladores de dosis medida y los nebulizadores. |
| En teoría, este procedimiento
debe generar, una concentración local alta en los pulmones, con
poca difusión a nivel sistémico, una respuesta terapéutica
muy rápida, en general en minutos, y debe mejorar en grado notable
la proporción terapéutica, al llevar al mínimo los
efectos adversos a nivel general. |
| Dado que en la fisiopatología
del asma únicamente están afectadas las vías respiratorias,
son importantes las ventajas teóricas de los aerosoles con efectos
sistémicos limitados. |
| Al utilizar esta vía en la
administración de fármacos, incluso en circunstancias ideales,
se asienta en los pulmones únicamente una pequeña fracción
de la droga en aerosol (2-10% de modo característico), el resto
se deglute. Por tal razón, para que surjan mínimos efectos
sistémicos, un medicamento en aerosol debe absorberse muy poco en
las vías gastrointestinales o ser inactivado a muy breve plazo durante
su primer paso por el hígado. Aún más, toda maniobra
que ocasiona mayor porcentaje de depósito en los pulmones y menor
fracción del fármaco que llega a las vías gastrointestinales
debe mejorar el índice terapéutico. |
| El tratamiento satisfactorio con aerosol
requiere que cada paciente domine la técnica de administración
de la droga. La cuidadosa demostración de la técnica de inhalación
por parte del médico, enfermera o educador del paciente es imperativa
y a menudo requiere esfuerzos reiterados, ya que muchos pacientes, en particular
los niños y ancianos no utilizan técnicas óptimas,
a menudo por instrucciones inadecuadas o insuficientes. |
| También debe explicársele
al paciente, que no debe rebasar la dosis recomendada (número de
aplicaciones), ya que esto intensificará los efectos adversos y
que, durante los lapsos en que sus síntomas se agravan, no debe
automedicarse, ya que la falta de respuesta al inhalador indica la necesidad
de una terapia alternativa y no el aumento de las dosis máximas
del inhalador. |
| § Vía Oral |
| la administración oral de estas
sustancias para obtener broncodilatación tiene un mayor riesgo de
producir efectos adversos. |
| Hay dos situaciones en que se utilizan
a menudo los agonistas b -adrenérgicos orales: |
| En primer lugar, los niños
de corta edad (menores de 5 años) que no pueden manipular los inhaladores
de dosis medidas y que presentan sibilancias ocasionales, en casos de infecciones
virales de las vías respiratorias, toleran de manera adecuada y
se benefician de ciclos breves de albuterol en jarabe. |
| En segundo término, en algunos
individuos con exacerbaciones asmáticas graves, cualquier aerosol
introducido por inhalador de dosis medida o por nebulizador, puede irritar
y empeorar la tos y el broncoespasmo, además de los inconvenientes
que para ellos tiene el uso del inhalador. |
| En tales casos, la ingestión
de agonistas adrenérgicos beta2 puede ser eficaz. Sin
embargo, en los adultos es mayor la frecuencia de efectos sistémicos
adversos con los fármacos orales que en los niños. |
| ª Vía parenteral |
| Solo debe ser reservada para las emergencias. |
-
Efectos adversos de los simpaticomiméticos
|
| Son el resultado de la actividad excesiva
de los receptores adrenérgicos, es decir, estos efectos se deben
principalmente a la extensión de las acciones farmacológicas
y los sistemas más involucrados son el cardiovascular y nervioso
central. |
| Con relación al aparato cardiovascular,
los efectos adversos principales cuando se usan estos agentes, se deben
a estimulación de los receptores a 1 y b
1
adrenérgicos. Incluyen, elevaciones notables de la presión
arterial, lo que puede provocar hemorragia cerebral o edema pulmonar. El
aumento del trabajo cardíaco puede precipitar una angina grave o
infarto del miocardio. También con frecuencia, los simpaticomiméticos
betaestimulantes provocan taquicardia y lo más importante pueden
causar arritmias ventriculares graves. El riesgo de estos efectos es mayor
para pacientes con arteropatía coronaria de base o arritmias preexistentes. |
| En relación al sistema nervioso
central, puede presentarse sensación de inquietud, aprensión,
ansiedad, irritabilidad e insomnio. |
| Estos efectos adversos, por supuesto
son más probables cuando se usan agonistas adrenérgicos no
selectivos, y por cualquier otra vía que no sea la inhalatoria. |
| Cuando se utiliza la vía inhalatoria
y se administra agonistas b 2 selectivos, el efecto adverso
más frecuente es el temblor o tremor del músculo estriado.
Por lo general, se desarrolla tolerancia a este efecto; no está
claro si la tolerancia manifiesta desensibilización de los receptores
b 2 del músculo estriado o adaptación del sistema
nervioso central. |
-
Otros experimentos han demostrado que la presión
parcial de oxígeno arterial (PaO2) puede disminuir, cuando
se inicia tratamiento en pacientes con exacerbación aguda del asma.
Esto puede deberse a dilatación vascular pulmonar inducida por el
fármaco, lo cual da por resultado aumento de la desigualdad entre
ventilación y perfusión. Sin embargo, este efecto suele ser
leve y transitorio. Puede ser necesario oxígeno suplementario si
la PaO2 inicial disminuye de manera notable, o si ocurre una
gran disminución durante el tratamiento con el broncodilatador.
|
| Este efecto puede presentarse con
mayor frecuencia cuando el fármaco se administra por vía
inhalatoria. |
| Tolerancia: Se ha estudiado
con amplitud la tolerancia a los efectos de los agonistas b adrenérgicos,
tanto in vitro como in vivo. La administración prolongada
de estos fármacos, genera regulación decreciente de los receptores
beta en algunos tejidos y disminución de las reacciones farmacológicas.
Algunos estudios han demostrado solo un leve en la respuesta del músculo
liso de las vías respiratorias a la estimulación beta, después
de tratamientos prolongados con agonistas beta. Otros estudios, evidencian
pruebas de que el empleo regular de agonistas beta2 selectivos,
puede producir incremento en la hiperreactividad bronquial y deterioro
en el control de la enfermedad. |
| Otro estudio controlado, bien diseñado,
demostró que el uso regular de Formoterol inhalado, se relacionó
con un ligero empeoramiento de los síntomas asmáticos y de
la reactividad bronquial cuando se comparó con el uso del agente
solo, en una base de "cuando fuera necesario". |
| Aparentemente, la tolerancia no representa
un problema clínico mayor, en la mayoría de los asmáticos
que no exceden la dosificación recomendada de agonistas b adrenérgicos
durante períodos prolongados. |
| |
-
Cuando se administran por vía parenteral,
estos fármacos pueden incrementar las concentraciones de glucosa,
lactato y ácidos grasos libres en plasma y disminuir la concentración
de potasio.
|
| En algunos pacientes diabéticos
la hiperglucemia empeora cuando se utilizan estos fármacos y la
reducción de la concentración de potasio puede tener importancia
en los pacientes cardiópatas y en particular los que toman glucósidos
cardíacos y diuréticos. |
-
Uso de agentes b 2 adrenérgicos
y riesgo de muerte
|
| Los resultados de diversos estudios
epidemiológicos sugieren una posible relación adversa entre
el empleo prolongado de agonistas b adrenérgicos y la muerte o el
peligro grave de ésta, a causa del asma. |
| Aunque no se ha podido encontrar asociación
alguna entre, el riesgo de muerte por asma y el uso de agonistas beta,
cuando se requiera el empleo regular de estos fármacos durante períodos
prolongados, debe considerarse con seriedad proporcionar tratamiento adicional
o alternativo, como coricosteroides por inhalación. |
| Se debe recordar que los efectos adversos
de este grupo de fármacos son menos probables cuando se utilizan
agonistas b 2 selectivos y se aplican por inhalación,
que cuando el fármaco es no selectivo y se administra por vía
oral o parenteral. |
| En general, los agonistas de los receptores
b 2 adrenérgicos son broncodilatadores seguros y eficaces
cuando se administran en dosis y por la vía que eviten los efectos
adversos sistémicos. |
| J. Interacciones farmacológicas |
 El
agregado de aminofilina al tratamiento de dosis máximas de b agonistas
inhalatorio, no mejora la respuesta de broncodilatación.
El
agregado de aminofilina al tratamiento de dosis máximas de b agonistas
inhalatorio, no mejora la respuesta de broncodilatación. |
 Los
glucocorticoides parecen restaurar la sensibilidad de los receptores beta,
cuando se ha producido subsensibilidad en el tratamiento crónico
con agonistas b adrenérgicos, mejorando la respuesta a los mismos.
Los
glucocorticoides parecen restaurar la sensibilidad de los receptores beta,
cuando se ha producido subsensibilidad en el tratamiento crónico
con agonistas b adrenérgicos, mejorando la respuesta a los mismos. |
| |
| |
| ANTICOLINERGICOS |
| |
| INTRODUCCION |
| El sistema nervioso parasimpático
juega un importante papel en la regulación del tono bronquial motor. |
| Las fibras vagales hacen sinapsis
con los receptores nicotínicos y muscarínicos M1
de los ganglios parasimpáticos, ubicados en las vías respiratorias
y los activan; las fibras postganglionares cortas descargan acetilcolina
que actúa sobre los receptores muscarínicos M3
del músculo liso de las vías respiratorias. Las glándulas
submucosas están inervadas también por las neuronas parasimpáticas
y tienen receptores M3 de manera predominante. Esta estimulación
origina: - Contracción de la musculatura lisa bronquial. |
-
Secreción de las glándulas submucosas.
|
| Un grupo diverso de estímulos
genera incrementos reflejos de la actividad parasimpática que contribuye
a la broncoconstricción. |
| Los fármacos anticolinérgicos
de tipo atropínico bloquean competitivamente la acción de
la acetilcolina liberada en las terminaciones que llegan a la musculatura
lisa bronquial. |
| Su eficacia terapéutica dependerá
de hasta que punto el reflejo colinérgico bronconstrictor contribuya
al broncoespasmo total presente en el cuadro clínico y al parecer
la participación de las vías parasimpáticas en las
respuestas broncoespásticas varía entre las personas, además,
debemos recordar que en el asma, un componente broncoconstrictor fundamental
es la liberación de mediadores frente a los cuales los anticolinérgicos
son ineficaces. |
| Tiempo atrás, el tratamiento
con anticolinérgicos específicamente con la Atropina, fue
la piedra fundamental en el tratamiento del asma. |
| Sin embargo, la atropina produce espesamiento
de las secreciones bronquiales e inhibe la depuración mucociliar,
lo cual puede agravar el asma. Debido a esto, a los efectos colaterales
sistémicos y a la introducción de los agonistas b adrenérgicos,
el tratamiento con anticolinérgicos casi se extinguió. |
| Actualmente, el tratamiento anticolinérgico
de la patología respiratoria se ha renovado, en gran parte debido,
al mejor conocimiento del papel de las vías parasimpáticas
en el broncoespasmo de algunos asmáticos y a la introducción
del bromuro de ipratropio un compuesto anticolinérgico cuaternario,
que posee mejores propiedades farmacológicas que los fármacos
previos. |
-
AGENTES ESPECIFICOS
|
-
Bromuro de ipratropio
|
| 1.a. Mecanismo de Acción:
Inhibe competitivamente el efecto de la acetilcolina en los receptores
muscarínicos. En las vías repiratorias, la acetilcolina es
liberada de terminaciones eferentes de los nervios vagos y los antagonistas
muscarínicos pueden bloquear de manera eficaz la contracción
del músculo liso de las vías respiratorias y el aumento en
la secreción de moco que se presenta en respuesta a la actividad
vagal. |
| 1.b. Farmacocinética:
Por ser un derivado cuaternario de la atropina, se absorbe muy mal y de
manera errática cuando se administra por vía oral. |
| No penetra con facilidad las membranas,
por ejemplo: conjuntiva, barrera hematoencefálica, etc. |
| Se administra por vía inhalatoria,
donde ejerce un efecto broncoselectivo: sus acciones se confinan casi por
completo a la boca y las vías respiratorias. Menos del 1% atraviesa
el epitelio bronquial y los niveles sanguíneos alcanzados son inapreciables
( se puede describir como una forma tópica de atropina). |
| La escasa proporción absorbida
desaparece del plasma con una vida media de casi 3 horas. |
| Se elimina por las heces. |
| Después de la inhalación,
suelen desarrollarse reacciones máximas en plazo de 30-90 minutos
y los efectos importantes pueden persistir durante más de 4 horas. |
| 1.c. Acciones Farmacológicas:
Como
ya se ha mencionado, cuando se inhalan soluciones de este fármaco,
sus acciones se limitan casi por completo a la boca y a las vías
respiratorias. Incluso, cuando se administra en cantidades muy superiores
a la recomendada, ocurren muy pocos cambios o ninguno en otros órganos
o sistemas. |
| A nivel de las vías respiratorias
el bromuro de ipratropio produce broncodilatación, inhibe la secreción
bronquial pero no tiene acción sobre la depuración mucocociliar
( a diferencia de la atropina). |
| Esta broncodilatación es más
lenta y menos intensa que la producida por los agonistas beta adrenérgicos. |
| 1.d. Efectos Adversos: Son
poco frecuentes debido a su poca absorción, pero serían los
mismos de la atropina: taquicardia, xerostomía, visión borrosa,
constipación, retención urinaria, etc., si se llegaran a
presentar, pero recordar la poca probabilidad de que éstos se produzcan
con este agente. |
| USOS CLINICOS |
| La principal aplicación clínica
del bromuro de ipratropio está en el tratamiento de la enfermedad
pulmonar obstructiva crónica. Es menos eficaz en la mayoría
de los pacientes asmáticos. Existe la combinación de bromuro
de ipratropio y agonistas b 2 adrenérgicos (fenoterol),
lo cual genera una broncodilatación un poco mayor y más duradera
que la administración de uno u otro fármaco solo, en el asma
" intercrítica" o basal. |
| En la broncoconstricción aguda
es más eficaz la combinación antes mencionada que cualquier
compuesto solo y más adecuada que administrar simplemente una dosis
mayor de agonista b 2 adrenérgico. |
| El bromuro de ipratropio se expende
en inhaladores de dosis medidas y en solución para nebulizador. |
| La mezcla de bromuro de ipratropio
y fenoterol (Berodual â ) se expende en inhalador de dosis medidas. |
| |
| |
| METILXANTINAS |
| |
| INTRODUCCION |
| Las metilxantinas son alcaloides obtenidos
de plantas de distribución geográfica muy amplia. Las más
importantes son: - La cafeína |
|
|
|
la teobromina
|
| Químicamente, la cafeína,
la teofilina y la teobromina son xantinas metiladas. |
| La xantina misma es dioxipurina. La
cafeína es la 1,3,7 trimetilxantina; la teofilina es la 1,3 dimetilxantina
y la teobromina es la 3,7 dimetilxantina. |
| Las metilxantinas están contenidas
en el té ( una taza de té contiene aproximadamente 50 mg
de cafeína y 1 mg de teofilina), en el café (una taza contiene
de 65 a 175 mg de cafeína), en la cocoa (una taza contiene 250 mg
de teobromina y 5 mg de cafeína), en el chocolate (una barra de
30 g puede tener 25 mg de cafeína por onza) y en las bebidas tipo
cola (360 ml de cualquier bebida tipo cola: pepsi-cola, coca-cola, brown-cola,
tiene aproximadamente de 40 a 50 mg de cafeína). |
| Desde el punto de vista terapéutico,
solo la teofilina y sus sales: aminofilina y oxtrifilina son usadas como
broncodilatadores. |
-
MECANISMO DE ACCION
|
| Se han propuesto diversos mecanismos
para explicar los efectos fisiológicos y farmacológicos de
las xantinas, entre los cuales tenemos: |
-
Inhibición de la fosfodiesterasa.
|
|
Efectos directos en la concentración de calcio
intracelular.
|
|
Acciones indirectas en las cifras de calcio intracelular
por hiperpolarización de la membrana celular
|
|
El desacoplamiento del calcio intracelular aumenta
con los elementos contráctiles del músculo.
|
|
ANTAGONISMO DE LOS RECEPTORES DE ADENOSINA.
|
|
Durante muchos años se consideró que
el principal mecanismo de acción de la teofilina y compuestos relacionados,
era la inhibición de la enzima fosfodiesterasa, lo cual permitía
la acumulación del AMPc dentro de las células del músculo
liso bronquial. Se dice que el incremento del AMPc intracelular causaría:
broncodilatación, vasodilatación e inhibición de la
liberación de mediadores.
|
|
Este efecto se pudo demostrar "in vitro" a
altas concentraciones, pero, no es seguro que se logren concentraciones
suficientemente altas "in vivo" para inhibir la fosfodiesterasa.
Por otra parte, varios derivados de la teofilina, con una potente acción
inhibidora de la fosfodiesterasa son broncodilatadores poco eficaces.
|
